Anvisa pede mais dados para autorizar Coronavac em crianças de 3 a 5 anos
Segundo a Agência Nacional de Vigilância Sanitária, a liberação da vacina foi pedida pelo Butantan em 11 de março.
Nessa quinta-feira (14), a Agência Nacional de Vigilância Sanitária (Anvisa) informou que pediu ao Instituto Butantan mais dados para saber se a liberação da vacina CoronaVac é segura para ser indicada a crianças de 3 a 5 anos.
A Anvisa disse que os estudos enviados pelo Instituto são insuficientes para recomendar a liberação do imunizante contra a covid-19 para a faixa etária.
Segundo a Anvisa, a liberação da vacina foi pedida pelo Butantan em 11 de março e o instituto solicitou uma alteração na bula da Coronavac, para que ela fosse recomendada para crianças de 3 a 5 anos. Atualmente, o imunizante também está liberado para crianças e adolescentes na faixa etária de 6 a 17 anos.
De acordo com a Anvisa, após avaliações de especialistas concluíram que os dados eram insuficientes para indicar a vacina para a faixa etária.
“Após avaliação das considerações das sociedades médicas e dos estudos enviados pelo Instituto Butantan, os especialistas da Anvisa concluíram que os dados apresentados são insuficientes para a conclusão sobre o uso da vacina Coronavac para crianças de 3 a 5 anos”, disse.
Conforme a Agência, é essencial a submissão de dados complementares sobre estudos em andamento para caracterizar o benefício da vacina e solicitou ao Butantan um ofício detalhando todos os dados necessários para o cumprimento dos requisitos para a autorização do uso do imunizante na faixa etária solicitada.
Ainda de acordo com a Anvisa, entre outros dados, foram solicitadas mais informações detalhando qual é a proteção conferida pela vacina Coronavac nessa população após o intervalo de dois a três meses e, também, após a vacinação completa com o esquema de 2 doses, “em cenário de predominância da variante Ômicron”.
A agência afirmou que também quer o tempo de proteção contra o vírus apontado nos estudos e dados sobre o protocolo de estudo clínico para avaliação de “imunogenicidade e segurança da terceira dose ou dose de reforço da vacina Coronavac em população pediátrica todas as faixas etárias”.
A instituição destacou ainda que foram solicitados ao Butatan dados do relatório clínico de fase 3 de estudos da vacina realizados na China para avaliação comparativa de imunogenicidade em crianças e adultos; e de estudos da mesma fase conduzidos na África do Sul, Chile, Malásia e Filipinas, para avaliar a imunogenicidade, segurança e eficácia da vacina em crianças e adolescentes de 6 meses a 17 anos.
O prazo para a avaliação do uso emergencial da CoronaVac na população de 3 a 5 anos será de até 30 dias após o envio dos dados complementares enviados pelo Butantan, segundo a Anvisa.
Com informações da Agência Brasil
Anvisa
Vacina contra Covid-19
-
Vigilância Sanitária emite recomendação para controle de "superfungo" no Piauí
Conforme a recomendação, o superfungo pode acometer pacientes hospitalizados, causando infecções invasivas e de alta mortalidade. -
Sesapi realizará oficina sobre combate ao tabagismo para profissionais do SUS
De acordo com a Sesapi, a oficina ocorrerá no âmbito da campanha do Dia Mundial sem Tabaco, celebrada em 31 de maio. -
FMS de Teresina faz abertura da campanha de vacinação contra HPV nesta sexta
De acordo com a FMS, o evento, acontecerá na Unidade Básica de Saúde (UBS) do Buenos Aires e será aberto ao público. -
Silvio Mendes e bancada federal se reúnem com ministro da Saúde em Brasília
O encontro teve como objetivo discutir soluções e buscar o aumento de recursos destinados à assistência em saúde na capital piauiense. -
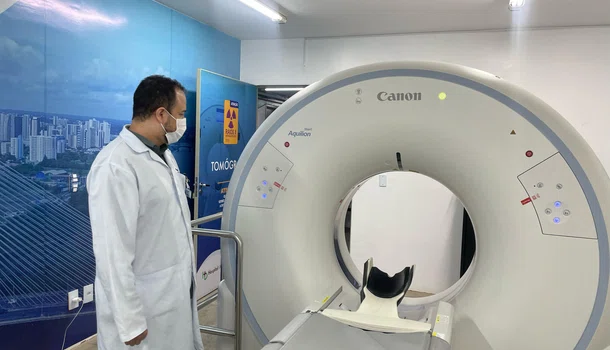
Hospital do Dirceu amplia exames de tomografia e melhora atendimento em Teresina
A unidade de saúde passou de 30 para 500 exames mensais, beneficiando paciente da rede municipal da capital.









E-mail
Messenger
Linkedin
Gmail
Tumblr
Imprimir